Aquellos compuestos que han llegado a superar la fase preclínica con buenas perspectivas pasan a investigarse en seres humanos (investigación clínica).
Este tipo de investigación tiene importantes connotaciones de índole científica, ética, social y económica.
Este tipo de investigación tiene importantes connotaciones de índole científica, ética, social y económica.
En todas las sociedades avanzadas es obligatorio demostrar la eficacia y seguridad de los medicamentos antes de su comercialización, tarea que se lleva a cabo mediante los ensayos clínicos.
El ensayo clínico se define como toda investigación en seres humanos para determinar o confirmar los efectos clínicos, farmacológicos, farmacodinámicos y/o detectar reacciones adversas y/o estudiar la absorción, distribución, metabolismo y excreción de un medicamento con el fin de determinar su seguridad y eficacia.
Los ensayos clínicos se basan en una amplia documentación y regulación tanto nacional como internacional y una serie de códigos éticos, declaraciones y convenios internacionales.
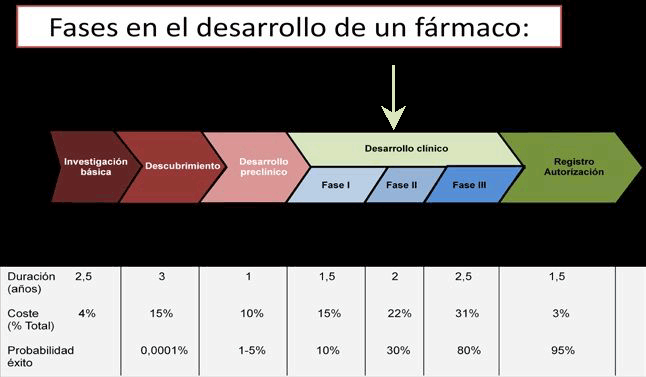
En los últimos cincuenta años se han producido cientos de miles de compuestos, pero tan sólo un 10% de ellos superaron la evaluación clínica e incluso dentro de este grupo algunos fueron retirados tras su comercialización debido a las continuas revaluaciones en su seguridad y eficacia.
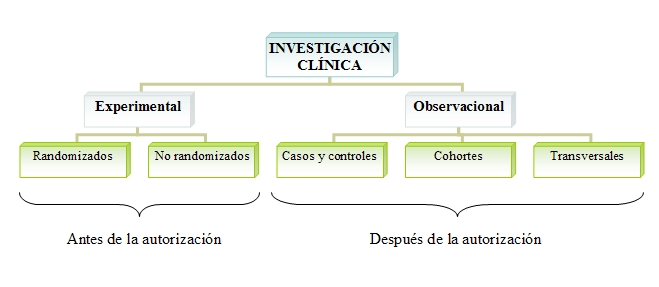
La metodología de la investigación clínica puede realizarse de modo:
▣ Experimental: En el ensayo experimental, el investigador diseña el estudio, selecciona los pacientes, establece los tratamientos y variables a analizar.
▣ Observacional: El investigador es mero observador de lo sucedido, sin alterar e intervenir la práctica clínica habitual.
Dentro de los ensayos experimentales encontramos:
▣ Ensayos randomizados en el que los pacientes forman parte de un tratamiento u otro de manera aleatoria. Utilizar el azar para adjudicar los pacientes a un tratamiento determinado es el procedimiento exigido por las agencias reguladoras para así, evitar el sesgo en la interpretación de los datos obtenidos antes de conceder la autorización para la puesta en el mercado del medicamento.
▣ Ensayos no randomizados en los que los pacientes no se distribuyen de manera aleatoria.
Entre los estudios observacionales que se realizan tras la comercialización del fármaco para desarrollar el perfil completo de eficacia y seguridad destacan:
▣ Casos y controles: los participantes se seleccionan en función de que tengan o no una determinada enfermedad y se investiga si estuvieron expuestos o no a una característica de interés, comparando el grupo de expuestos con el grupo de control.
▣ Cohortes: se hace una comparación de la frecuencia de una enfermedad entre dos poblaciones, una expuesta a un factor de riesgo y la otra libre de él.
▣ Transversales: examina la relación entre una enfermedad y una serie de variables en una población determinada y en un momento del tiempo.
Los ensayos clínicos pasan cronológicamente por tres fases hasta la autorización o comercialización del medicamento. Una vez comercializado, se pasa a la fase IV que dura toda la vida útil del medicamento, en la cual puede producirse la retirada del mismo si se detectan características desfavorables desconocidas en las tres fases previas del ensayo. Estos nuevos efectos pueden descubrirse al emplearse el fármaco en un entorno real de práctica clínica administrándose a miles de pacientes.
La eficacia medida en estas condiciones reales de la práctica asistencial se denomina efectividad, diferenciándola de esta manera de la eficacia medida previamente a la distribución del medicamento.
Fuentes: CEU Universidad San Pablo: Farmacología Básica, 2013.
http://cmidd.northwestern.edu/about/drug-discovery-and-development-process/
http://indacea.org/desarrollo-de-medicamentos-1/
http://cmidd.northwestern.edu/about/drug-discovery-and-development-process/
http://indacea.org/desarrollo-de-medicamentos-1/






Tu opinión es importante
Estás invitado a enviar cualquier comentario o aportación que quieras realizar, gracias.